
Beachten Sie die zwei Zählnetze, die als Kreuz erkennbar sind.
Da die Blutzellen in Bezug auf das Volumen (pro Liter) gezählt werden, ist es unerlässlich, dass das Bluvolumen, in dem die Zellen gezählt werden, einer bekannten Grösse entspricht. Dies ermöglicht die Neubauer-Zählkammer.
 |
Bei der Neubauer-Zählkammer handelt es sich um einen speziellen Objektträger, auf dem zwei 3 x 3 mm grosse Zählnetze eingraviert wurden. |
| Neubauer-Zählkammer mit Deckglas, Ansicht von oben Beachten Sie die zwei Zählnetze, die als Kreuz erkennbar sind. |
|---|
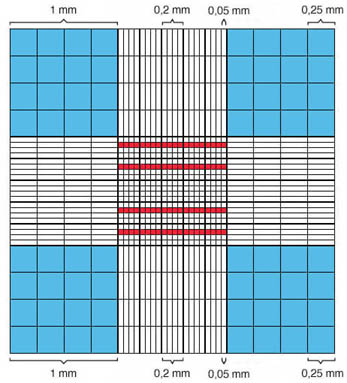 |
Das Zählnetz setzt sich aus 9 1 x 1 mm messenden grossen Quadraten zusammen. Von diesen Quadraten enthält das zentrale Quadrat 25 mittlere Quadrate von 0,2 x 0,2 mm Seitenlänge, welche wiederum in 16 kleine Quadrate von 0.05 x 0.05 mm Seitenlänge aufgeteilt sind. Das grosse zentrale Quadrat wird auch Erythrozytennetz genannt. Die mit rot hervorgehobenen Qudrate entsprechen 80 kleinen Quadraten, die für die Erythrozyten- und Thrombozytenzählung benutzt werden. Die hier mit blau markierten grossen Quadrate dienen der Leukozytenzählung. |
| Schematische Darstellung des Zählnetzs der Neubauer-Zählkammer: blau = Bereich der Leukozytenzählung rot = Bereich der Erythrozyten- und Thrombozytenzählung |
|---|
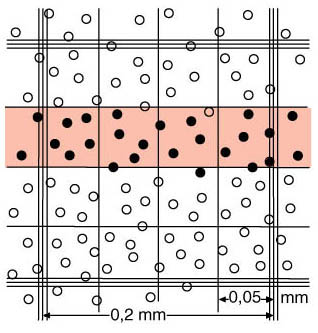 |
Bei der Zählung in der Kammer werden alle Zellen mitgezählt, die auf der linken und auf der unteren Grenzlinie liegen oder diese gerade noch berühren. Nicht mitgezählt werden alle Zellen, die auf der oberen und der rechten Grenzlinie liegen oder diese gerade noch berühren. Diese Vorgehensweise wird auch L-Form-Regel genannt. |
| Schematische Darstellung eines mittelgrossen Quadrates (0.2 x 0.2 mm) des Erythrozytennetzes der Neubauer-Zählkammer. |
|---|
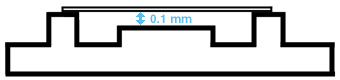
Schematische Darstellung der Neubauer-Zählkammer, seitliche Ansicht |
Beidseits des Zählnetzes befindet sich jeweils ein Steg. Bevor darauf ein geschliffenes Deckglas gelegt wird, werden die Stege angefeuchtet. Liegt das Deckglas satt auf, besteht zwischen Zählnetz und Deckglass ein Abstand von 0.1mm (Kammertiefe). Das Volumen, das somit über den Quadraten des Zählnetzes liegt, entspricht bei einem grossen Quadrat 0.1µl (1mm x 1mm x 0.1mm = 0.1mm3 = 0.1µl) und bei einem kleinen Quadrat 0.00025µl (0.05mm x 0.05mm x 0.1mm = 0.00025mm3 = 0.00025µl). |
|---|---|

Photografische Darstellung der Neubauer-Zählkammer |
Bei der Erythrozytenzählung werden 10 µl EDTA-Blut (mit Kolbenhubpipette {Eppendorfpipette} aufziehen) in 1990 µl isotoner Erythrozytenverdünnungslösung verdünnt. Dies entspricht einer Verdünnung von 1:200. Diese Suspension muss gut gemischt und sofort in die Zählkammer eingefüllt werden. Nach ca. 3 Minuten sind die Erythrozyten sedimentiert und es kann mit der Auszählung der Erythrozyten in 80 kleinen Quadraten begonnen werden.
Die Berechnung der Erythrozytenzahl geschieht nach dieser Formel unter Verwendung folgender Grössen:
| Anzahl gezählter Erthrozyten(I) x Verdünnung(II) Anzahl ausgezählter Quadrate(III) x Volumen über Quadrat(IV) |
= | Erythrozyten
µl |
= | Erythrozyten x 106(V)
L |
|---|
Beispiel mit 420 gezählten Erythrozyten:
| 420 Ec x 200
80 x 0.00025 µl |
= | 84'000 Ec
0.02 µl |
= | 4'200'000 Ec
µl |
= | 4'200'000 Ec x 106
L |
= | 4.2 x 1012 Ec/L |
|---|
Minimale Anzahl zu zählender Erythrozyten = 400
Bei 80 kleinen Quadraten werden bei normalen Erythrozytenwerten rund 400 Erythrozyten gezählt. Dies ergibt ein Variationskoeffizient (Streubreite) von ±5%. Dies ist der maximal tolerierbare zufällige Fehler (Genauigkeit). Sind aber bei einem Patienten die Erythrozyten erniedrigt (Anämien, ausser Thalassämien), nimmt die Streuung zu und somit die Genauigkeit ab. Bei einer Polyzythämie hingegen nimmt mit steigender Erythrozytenzahl prinzipiell die Genauigkeit zu. Wegen Überlagerungen der Erythrozyten muss aber oft eine höhere Verdünnung gewählt werden. Bei tiefen Erythrozytenzahlen muss hingegen die Anzahl ausgezählter Quadrate erhöht oder die Verdünnung (z.B. 1:100) vermindert werden, um die Genauigkeit wieder in den akzeptablen Bereich zu bringen.
Bei der Leukozytenzählung werden 50 µl EDTA-Blut (mit Kolbenhubpipette aufziehen) in 950 µl Verdünnungslösung (z.B. Türk'sche Lösung, mit Kolbenhubpipette aufziehen) gemischt. Dies entspricht einer Verdünnung von 1:20. Hierbei werden die Erythrozyten lysiert und die Leukozytenkerne angefärbt. Nach dem Mischen wird die Zählkammer sofort gefüllt. Nach 2 Minuten kann mit der Auszählung der Leukozyten in den 4 grossen Quadraten begonnen werden.
Die Berechnung der Leukozytenzahl geschieht nach folgender Formel unter Verwendung folgender Grössen:
| Anzahl gezählter Leukozyten(I) x Verdünnung(II) Anzahl ausgezählter Quadrate(III) x Volumen über Quadrat(IV) |
= | Leukozyten
µl |
= | Leukozyten x 106(V)
L |
|---|
Beispiel mit 150 gezählten Leukozyten:
| 150 Lc x 20 4 x 0.1 µl |
= | 3000 Lc 0.4 µl |
= | 7500 Lc
µL |
= | 7500 Lc x 106
L |
= | 7.5 x 109 Lc/L |
|---|
Minimale Anzahl zu zählender Leukozyten = 100
Da die Leukozytenzahlen schon physiologischerweise grössere Schwankungen aufweisen, wird ein Variationskoeffizient von ±10% akzeptiert. Hierzu müssen mindestens 100 Leukozyten gezählt werden. Wie schon bei der Erythrozytenzählung erwähnt, sinkt die Genauigkeit mit abnehmenden Leukozytenzahlen und steigt mit zunehmenden Werten. Bei tiefen Leukozytenzahlen muss darum die Anzahl ausgezählter Quadrate erhöht oder die Verdünnung (z.B. 1:10) vermindert werden, um die Genauigkeit wieder in den akzeptablen Bereich zu bringen.
Da bei diesem Verfahren Normoblasten nicht als solche erkannt werden, kann ein hoher Anteil an Normoblasten das Resultat verfälschen. Dies gilt auch für die maschinelle Leukozytenzählung. Der Anteil der Normoblasten kann einzig im Blutausstrich erfasst werden und wird in Anzahl Normoblasten pro 100 Leukozyten ausgedrückt. Bei mehr als 5 Normoblasten auf 100 Leukozyten muss eine Korrektur erfolgen.
Die Normoblastenkorrektur geschieht nach folgender Formel:
| Anzahl gezählter Leukozyten x 100 Anzahl Normoblasten pro 100 Leukozyten + 100 |
|||||||
|---|---|---|---|---|---|---|---|
| Beispiel mit 12 Normoblasten auf 100 Leukozyten bei einer Leukozytenzahl von 5.6 x 109/L: | |||||||
| 5.6 x 109 Lc/L x 100
12 + 100 |
= | 5.6 x 109 Lc/L x 100
112 |
= | 5.6
1.12 |
x 109 Lc/L | = | 5.0 x 109 Lc/L |
Bei der Thrombozytenzählung werden 50 µl EDTA-Blut (mit Kolbenhubpipette aufziehen) in 950 µl Verdünnungslösung (mit Kolbenhubpipette aufziehen) gemischt. Dies entspricht einer Verdünnung von 1:20. Damit die Erythrozyten vollständig lysiert werden, muss das Gemisch rund 5 Minuten stehen gelassen werden. Danach wird die Suspension nochmals gut gemischt und in die Zählkammer gefüllt. Diese wird für 20-30 Minuten in einer feuchten Kammer belassen, damit die Thrombozyten sedimentieren können, ohne dass die Kammer austrocknet. Wie bei der Erythrozytenzählung werden 80 kleine Quadrate ausgezählt.
Die Berechnung der Thrombozytenzahl geschieht nach folgender Formel unter Verwendung folgender Grössen:
| Anzahl gezählter Thrombozyten(I) x Verdünnung(II) Anzahl ausgezählter Quadrate(III) x Volumen über Quadrat(IV) |
= | Thrombozyten
µl |
= | Thrombozyten x 106(V)
L |
|---|
Beispiel mit 230 gezählten Thrombozyten:
| 230 Tc x 20 80 x 0.00025 µl |
= | 4'600 Tc 0.02 µl |
= | 230'000
µl |
= | 230'000 Tc x 106
L |
= | 230 x 109 Tc/L |
|---|
Minimale Anzahl zu zählender Thrombozyten = 100
Bei den Thrombozyten wird ebenfalls ein Variationskoeffizient von ±10% akzeptiert. Hierzu müssen mindestens 100 Thrombozyten gezählt werden. Bei tiefen Thrombozytenzahlen muss darum die Anzahl ausgezählter Quadrate erhöht oder die Verdünnung (z.B. 1:10) vermindert werden, um die Genauigkeit wieder in den akzeptablen Bereich zu bringen. Man kann auch eine zweite Kammer auszählen.
Bei der manuellen Leukozytendifferenzierung werden in einem mit May-Grünwald-Giemsa gefärbten Blutausstrich die verschiedenen Leukozytenarten im Mikroskop gezählt. Da die Leukozyten nicht gleichmässig im Ausstrich verteilt sind und dieselbe Zelle nicht mehrmals gezählt werden darf, muss das Präparat systematisch durchmustert werden.
 |
 |
| Gezogener Ausstrich | Gestossener Ausstrich |
|---|
Man differnziert mindestens 100 Leukozyten aus, idealerweise aber 2 x 100 (in zwei Ausstrichen). Bei schweren Leukopenien ist es fast nicht möglich, mehr als 100 Leukozyten auszuzählen. Hingegen sollten bei sehr hohen Leukozytenzahlen 400 Leukozyten differenziert werden. Die so gewonnen Prozentzahlen werden anhand der Leukozytenzahl in absolute Werte umgerechnet (z.B. 20% Lymphozyten bei einer Leukozytenzahl von 6.0 x 109/L entsprechen 0.2 x 6.0 = 1.2 x 109/L).
Auch hier muss wieder die Genauigkeit besprochen werden. Da Leukozyten wie Eosinophile und Basophile nur einen kleinen Anteil der Gesamtzahl der Leukozyten ausmachen, ist die Genauigkeit ihrer Werte ziemlich gering, wenn nur 200 Leukozyten differenziert werden. Dies fällt besonders dann ins Gewicht, wenn die Leukozytenzahl sehr hoch ist (z.B. 1 Eosinophiler auf 100 Leukozyten bei einer Leukozytenzahl von 60.0 x 109/L entspricht schon 0.6 x 109/L). Wie stark die Werte der Leukozytendifferenzierung abhängig von der Anzahl differenzierter Zellen variieren können, ist aus der Rümke-Tabelle (siehe unten) ablesbar.
Liegt zum Beispiel der wirkliche Anteil der Basophilen bei einem Patienten bei 5%, so kann der bei Auszählung von 100 Leukozyten gefundene Wert zwischen 2 und 11% liegen. Erst bei der Auszählung von 10'000 Zellen (nur durch Automaten zu bewältigen) ist der Wert auf ±10% genau. Bei einem Anteil von 50% ist diese Genauigkeit immerhin schon bei 500 ausgezählten Leukozyten erreicht.
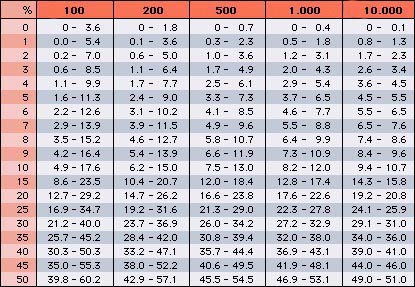 |
| Rümke-Tabelle % = prozentualer Anteil einer Leukozytenart an der Gesamtzahl dunkelrot unterlegt = Anzahl differenzierter Leukozyten (Tabelle modifiziert nach der CD-ROM "Das interaktive Handbuch der Hämatologie") |
|---|
Die Retikulozyten werden vorgängig unfixiert entweder mit Neuem Methylenblau oder Brillantkresylblau (Supravitalfärbung) gefärbt und auf einem gewöhnlichem Objektträger ausgestrichen. Zur Zählung benutzt man ein spezielles Okular, bei dem das Blickfeld auf ein kleines Quadrat reduziert wird. Man zählt so 1000 Erythrozyten (je 500 in zwei Ausstrichen) und registriert dabei die Retikulozyten, die auf Grund ihrer retikulären Zeichnung gut erkennbar sind. Der Anteil Retikulozyten an den Erythrozyten wird in Prozent ausgedrückt.
Auch hier gilt, je tiefer der Anteil der Retikulozyten, desto ungenauer der gefundene Wert. Mit 1000 gezählten Erythrozyten wird bei einem Retikulozytenanteil von 1-2% (= Normbereich) eine Variationskeffizient von ±10% erreicht.